
|
Zadanie 5.
Badania związane z opracowaniem metod aplikacji cystatyny oraz modyfikowanych form frakcji liwetynowej żółtka z przeznaczeniem do wytworzenia preparatów w zastosowaniach biomedycznych i weterynaryjnych.
Kierownik
prof. Antoni Polanowski
Zespół
dr hab. Jakub Gburek, dr Krzysztof Gołąb, mgr Agnieszka Sosnowska, mgr Katarzyna Juszczyńska.

W ostatnim ćwierćwieczu nastąpił intensywny rozwój badań nad występującymi w żywności białkowymi związkami bioaktywnymi. W świetle hipotezy sugerującej, że każde białko jest źródłem peptydów o zróżnicowanej aktywności biologicznej (np. antyutleniającej, antymikrobiologicznej, antynowotworowej lub inhibitorowej), godne uwagi są łatwo dostępne, naturalne wysokobiałkowe produkty, które stanowią potencjalne źródło leków nowej generacji. Na szczególną uwagę zasługują jaja ptaków hodowlanych, które stanowią tani i odnawialny rezerwuar związków o znaczeniu farmakologicznym. Spośród wielu substancji występujących w surowcu jajczarskim do najważniejszych należą: lizozym, cystatyna, awidyna, immunoglobuliny i fosfolipidy. Na skalę przemysłową produkowany jest tylko lizozym. Niezbędne jest zatem opracowanie wydajnych metod wydzielania z jaj substancji biologicznie aktywnych celem rozwinięcia produkcji nowych środków farmaceutycznych i nutraceutycznych.
Celem badań było:
- opracowanie wydajnej metody otrzymywania ovocystatyny, białka charakteryzującego się szerokim spektrum działania antybakteryjnego oraz antynowotworowego oraz
- wykazanie obecności w żółtku jaja peptydów o właściwościach zbliżonych do kolostryniny siary, z możliwością ich otrzymywania dla celów farmaceutycznych oraz nutraceutycznych.
Ovocystatyna
Jest pierwszym wyizolowanym przedstawicielem dużej nadrodziny inhibitorów o nazwie cystatyny. Oprócz zdolności do hamowania proteinaz sulfhydrylowych wykazuje aktywność antymikrobiologiczną i antynowotworową, hamuje proces degradacji kości oraz rozwój bakterii (Porphyromonas gingivalis), powodującej stany zapalne przyzębia. Cystatyna występująca głównie w białku jaja pełni funkcję regulatorową podczas rozwoju embrionu, ale przede wszystkim chroni go przed proteazami cysteinowymi mikroorganizmów. Pozyskiwanie cystatyny z jaja jest, ze względu na jej małą zawartość oraz łatwość tworzenia pozbawionych aktywności inhibitorowej agregatów białkowych, drogie i mało wydajne.
Realizując założenia badawcze dotyczące cystatyny przyjęte w zadaniu, prace prowadzono w dwóch kierunkach:
- Pierwszy miał na celu otrzymanie niezbędnej ilości preparatu czystej cystatyny potrzebnej do podjęcia badań, przez inne zespoły projektu. Wykorzystując klasyczny sposób izolacji inhibitora wydzielono ponad 1 g. elektroforetycznie czystej cystatyny o wartości katalogowej przekraczającej 2 mln. złotych.
- W drugim etapie udoskonalono metodę preparacji z pominięciem chromatografii powinowactwa i wykorzystaniem przemysłowo suszonego białka jaja (Zakłady Jajczarskie OVOPOL, Nowa Sól), jako źródła inhibitora. Ponieważ założeniem projektu było między innymi,. otrzymanie czystego i stabilnego preparatu cystatyny, zadaniem podstawowym stała się wybiórcza ekstrakcja tego białka i jego oczyszczenie z wykorzystaniem odpowiednich technik chromatograficznych łatwych do zastosowania przemysłowego. Opracowana metoda ekstrakcji do etanolu pozwala uzyskać ekstrakty zawierające około 70-80 % aktywności cystatynowej stabilnej podczas przechowywania w lodówce przez wiele dni. Oczyszczenie jej z wykorzystaniem chromatografii jonowymiennej w buforowym roztworze etanolu w pH 5,3 z wykorzystaniem złóż o wysokiej pojemności wiązania i ulepszonych właściwościach hemodynamicznych (Sartobind MA75, Hi - Trap™) oraz chromatografii sitowomelekularnej (Sephacrylu S-100) daje w efekcie preparat o wysokiej czystości.
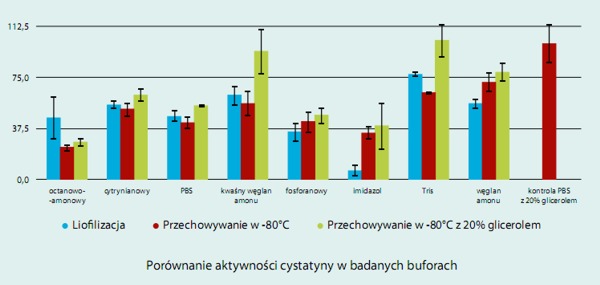
Realizując projekt badawczy opracowano wydajną metodę stabilizacji monomerycznej formy cystatyny jak i sposób jej kontrolowanej dimeryzacji dla celów badawczych i potencjalnie terapeutycznych.
Immunoglobulina Y
Kolejne zadanie badawcze dotyczyło wykazania funkcjonalnego podobieństwa pomiędzy białkami żółtka jaj ptaków a kolostryniną ssaczą. Wśród składników żółtka na szczególne wyróżnienie, ze względów terapeutycznych zasługuje immunoglobulina Y (IgY). Jej stężenie w żółtku waha się zakresie 5–25 mg/ml a podstawową rolą jest zapewnienie odpowiedniego poziomu biernej odporności zarodka do momentu pełnego rozwoju jego własnego układu immunologicznego. Przyjęto zatem hipotezę, że, podobnie jak w siarze, peptydy immunostymulujące towarzyszą IgG, w żółtku powinny one towarzyszyć IgY.
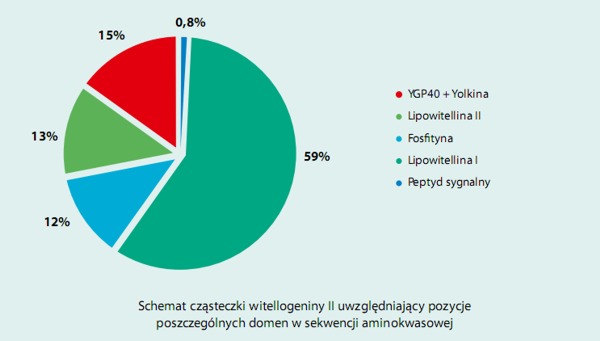
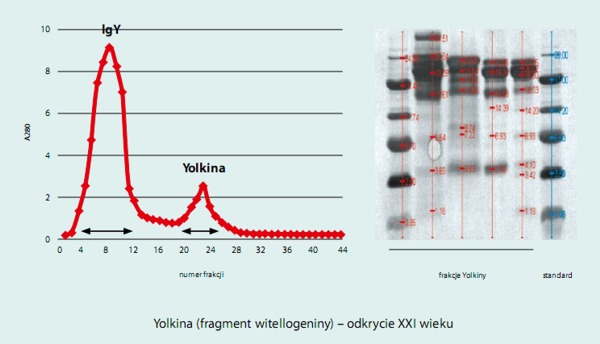
Z immunoglobuliny IgY żółtka jaj kurzych uzyskano kompleks białkowy, nazwany Yolkina, który charakteryzował się wysoką aktywnością immunostymulacyjną. Preparat Yolkiny okazał się mieszaniną peptydów o masach od około 4 do 36 kDa, dających się wydzielić zarówno w procesie wysokosprawnej chromatografii jak i elektroforetycznie. Ich skład aminokwasowy wyróżnia się wysoką zawartością reszt kwaśnych oraz znikomą zawartością metioniny. Na podstawie analizy N-końcowych sekwencji aminokwasowej 7 peptydów stwierdzono, że wszystkie są fragmentami C-końcowej domeny witellogeniny II.
W badaniach immunologicznych dowiedziono, że na komórkach pełnej krwi ludzkiej Yolkina wykazuje zdolność do indukcji wydzielania przez nie cytokin prozapalnych: TNF-α i IL-6 oraz cytokiny antyzapalnej IL-10 pełniącej kluczowa rolę w hamowaniu wydzielania wielu mediatorów reakcji zapalnej m.in. IFN, TNF-α czy IL-6. Otrzymane wyniki wskazują na fakt, iż badane peptydy wykazują działanie immunomodulatorowe i mogą odgrywać istotną rolę w regulacji odpowiedzi immunologicznej. Zatem Yolkina może być czynnikiem w walce z chorobami otępiennymi mózgu, zwłaszcza z chorobą Alzheimera. Opracowana metoda preparacji Yolkiny jest prosta i łatwo może być zaadaptowana do skali wielkolaboratoryjnej.
| Projekt współfinansowany ze środków Europejskiego Funduszu Rozwoju Regionalnego. | Kontakt |